Daß viele Erkrankungen einen genetischen Hintergrund haben, steht heutzutage außer Frage. Manche Krankheiten lassen sich mehr oder weniger genau Veränderungen auf bestimmten Abschnitten innerhalb der Chromosomen zuordnen, z.B. Mukoviszidose auf Chromosom 7 und Morbus Huntington auf Chromosom 4 (Übersicht).
| Alzheimersche Krankheit | Nachweis des E4-Allels des Apolipoprotein-E-Gens auf Chromosom 19 |
| Azoospermie | Nachweis von 31 Mutationen auf dem CFTR-Gen auf Chromosom 7 |
| Dickdarmkrebs | Nachweis fast aller theoretisch möglichen MLH1- und MSH2-Mutationen |
| Eierstockkrebs | Nachweis fast aller theoretisch möglichen BCRA 1- und BCRA 2-Mutationen |
| Eisenspeicherkrankheit (Hämochromatose) | Nachweis des Austausches der DNS-Basen Guanin zu Adenin an Position 845 und von Cytosin zu Guanin an Position 187 des HFE-Gens auf Chromosom 6 |
| Faktor V Leiden – Mutation (Gerinnung) | Nachweis der Leiden-V-Mutation |
| Familiäre Hypercholesterinämie | Nachweis fast aller vorkommenden Mutationen im Low-Density-Lipoprotein-Rezeptor-Gen und im Exon 26 des Apolipoprotein-B-Gens |
| Familiäre Hyperlipoproteinämie Typ III | Nachweis des E-2-Allels des Apolipoprotein-E-Gens auf Chromosom 19 |
| Familiärer Brustkrebs | Nachweis instabiler Abschnitte im FMR-1-Gen |
| Fragile X-Syndrom | Nachweis instabiler Abschnitte im FMR-1-Gen |
| Mukoviszidose (Cystische Fibrose) | Nachweis der 31 häufigsten Mutationen und somit über 87% der Merkmalsträger für diese Erkrankung in Deutschland |
| Muskeldystrophie | Nachweis einer Mutation (Basenaustausch von Guanin zu Thymin) im Intron 1 des Kollagen TypI Alpha-1-Gens“ |
| Osteoporose | Nachweis einer Mutation (Basenaustausch von Guanin zu Thymin) im Intron 1 des Kollagen TypI-Alpha1-Gens |
Wenn dem also so ist, müßte es möglich sein, möglichst noch vor Ausbruch einer Krankheit durch eine gezielte molekulargenetische Analyse herauszufinden, welche Anlagen zu einer Krankheit ein Mensch in sich trägt, um rechtzeitig vorsorgen zu können oder therapeutisch einzugreifen. Nach Informationen der Bundes-Ärztekammer gibt es weltweit etwa 1.000 Tests auf genetische Krankheiten, 300 davon als Routineuntersuchung im Labor. Rund 25 seien im Internet angeboten. Tab. 21 zeigt eine Auswahl von „Gentests“, mit denen genetische Veränderungen bei bestimmten Erkrankungen erfaßt werden können.
Bei der Vererbung genetischer Merkmale können vier verschiedene Prinzipien (Erbgänge) unterschieden werden: der autosomal-rezessive, der autosomal-dominante, der X-chrosomale und der mitochondriale Erbgang. Autosomal bedeutet, daß es sich um Merkmale auf einem oder mehreren der 22 Nicht-Geschlechtschromosomen (Autosomen) handelt, im Gegensatz zur X-chromosomalen und mitochondrialen Vererbung, die an die Geschlechtchromosomen (X,Y) bzw. Mitochondrien gebunden ist.
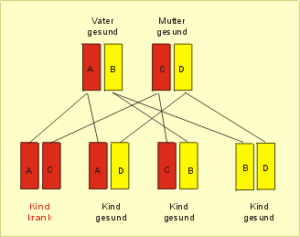
Man spricht von einer autosomal-rezessiven Erkrankung (Abb. 52), wenn an dem bestimmten Genort beide Chromosomen, also das väterliche und das mütterliche eine Veränderung aufweisen müssen, um krankheitswirksam zu sein. Wenn die Veränderung nur auf einem der beiden Chromosomen auftritt, kommt die Erkrankung beim Kind nicht zur Ausprägung.
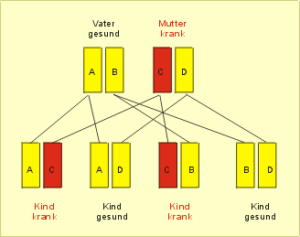
Eine autosomal-dominante Erkrankung (Abb. 53) liegt vor, wenn an dem fraglichen Genort des Chromosoms, entweder des väterlichen oder des mütterlichen, eine Veränderung vorliegt, und diese trotz eines normalen zweiten Chromosoms beim Kind zur Ausprägung der Erkrankung führt.
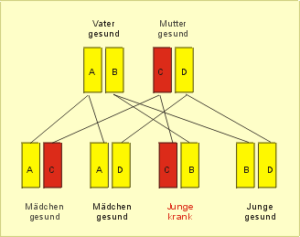
Das X-Chromosom ist keineswegs ein Chromosom, das nur geschlechtsspezifische Gene enthält. Unter den hunderten von Genen sind viele, die für wichtige Lebensfunktionen verantwortlich sind und bei einem Defekt zur Fehlbildung lebenswichtiger Moleküle führen und das Auftreten bekannter Krankheiten bewirken. Interessanterweise sind alle diese Erkrankungen rezessiv vererbbar. Das bedeutet: Trägt die Mutter einen Defekt in einem Chromososom des X-Chromosomen-Paares (Xkrank/Xgesund), so bleibt sie von der Krankheit verschont. Das zweite gesunde X-Chromosom „schützt“ die Frau sozusagen vor der Erkrankung. Sie ist also ein stiller Träger der Erbkrankheit (Konduktor). Sie bildet sowohl Eizellen mit Xkrankund andere mit Xgesund. Männliche Nachkommen erwerben so mit 50% Wahrscheinlichkeit von der Mutter Xkrank. Da der Sohn aber über kein zweites X-Chromosom verfügt (Xkrank/Y), bricht bei ihm die Krankheit aus (Abb. 54).
Dem beschriebenen Prinzip folgt eine ganze Reihe von geschlechtsgebundenen Erbkrankheiten , allen voran die Bluterkrankheit Hämophilie (in der Bundesrepublik Deutschland: 8000 Fälle), die auf der Fehlproduktion lebenswichtiger Gerinnungsfaktoren beruht oder die Rot-Grün-Blindheit, von der in Westeuropa etwa 8% der Männer betroffen sind. Davon haben 75% eine Mutation im Grün-Opsin-Gen und 25% einen Defekt im Rot-Opsin-Gen, was ein Fehlen an den entsprechenden Pigmenten in den jeweiligen Zapfen der Netzthaut verursacht.
Mitochondriale Erkrankungen beruhen in der Regel auf einer Mutation in einem Gen der ringförmigen Mitochondrien-DNS (vgl. Abschnitt „Das Mitochondriengenom“). Daneben gibt es solche Erkrankungen, die darauf beruhen, daß die Produktion wichtiger Enzyme, die von Genen des Zellkerns kodiert werden und nachträglich in die Mitochondrien transportiert werden, genetisch fehlgesteuert sind. Daher gibt es auch mitochondriale Erkrankungen mit einem autosomalen Vererbungsmuster. Mitochondrien werden nur von den Müttern mit dem Plasma der Eizelle an die Nachkommen weitergeben. Typisch für einen mitochondrialen Erbgang ist deshalb, daß nur Kinder von erkrankten Frauen, aber nie Kinder von erkrankten Männern ebenfalls erkranken. Beide Geschlechter sind jedoch in gleicher Weise betroffen. Die Wahrscheinlichkeit einer Erkrankung ist für Kinder von erkrankten Frauen hoch und beträgt fast 100%.
Die besprochenen Erbgänge beziehen sich hauptsächlich auf sogenannte monogen bedingte Erbkrankheiten, also auf solche, bei denen davon ausgegangen wird, daß Veränderung in einem einzelnen Gen entscheidend für die Erkrankung verantwortlich sind. In Wirklichkeit zeigen jedoch die klinische Erfahrungen als auch tierexperimentelle Studien, daß diese Erkrankungen komplexer Natur sind und von anderen Genen oder auch Umwelteinflüssen erheblich modifiziert werden können.
Allein die Tatsache, daß die meisten dieser Erkrankungen zum Teil extreme Unterschiede hinsichtlich des Zeitpunktes ihres ersten Auftretens, des Verlaufs als auch der Schwere ihrer Ausprägung aufweisen, deutet darauf hin, daß es sich bei den vermeintlich monogenen Erkrankungen um multifaktorielle Erscheinungen handelt, vergleichbar mit den Ursachen und der Vielgestaltigkeit der Krebserkrankungen.
Mit Sicherheit kommt der individuellen molekulare Ausstattung eine entscheidende Bedeutung zu. Erinnert sei an die weiter oben beschriebene epigenetische Prägung, also die gegenseitige Beeinflussung der Genexpression väterlicher und mütterlicher Chromosomen. Aber auch die gesamten Lebensumstände, Ernährung, „Streß“, Drogen- und Medikamentengebrauch und -mißbrauch tragen zur phänotypischen Genexpression bei (vgl. Abschnitt „Individuelle Therapie“).
| Erkrankung | Allel | Relatives Risiko |
|---|---|---|
| Morbus Bechterew | B27 | 87,4 |
| Morbus Reiter | B27 | 37,0 |
| Subakute Thyreoiditis | B35 | 13,7 |
| Psoriasis vulgaris | Cw6 | 13,3 |
| Zöliakie | DR3 | 10,8 |
| Morbus Basedow | DR3 | 3,7 |
| Diabetes mellitus Typ I | DR3/DR4 | 7,9 |
| Myastenia gravis | DR3 | 2,5 |
| System. Lupus erythem. (SLE) | DR3 | 5,8 |
| Multiple Sklerose | DR2 | 4,1 |
| Rheumatoide Arthritis | DR4 | 4,2 |
| Hashimoto Thyreoiditis | DR3/DR5 | 3,2 w>m |
| Perniziöse Anämie | DR5 | 5,4 |
| Morbus Behcet | B5 | 6,3 |
| Juvenile chron. Arthritis | DRw8 | 3,6 |
Als letzte sollen noch Krankheiten Erwähnung finden, die eine gewisse Assoziation zum Auftreten definierter HLA-Gewebenantigene aufweisen (Tab. 22). Allen gemeinsam ist ihr Hintergrund, nämlich autoimmune Prozesse. Das relative Risiko, an einer der erwähnten Krankheiten zu erkranken, wird durch das Verhältnis der Häufigkeit des Auftretens der Krankheit bei Merkmalsträgern zu Nicht-Merkmalsträgern beschrieben. Bei Personen mit einem hohen relativen Risiko gibt es demzufolge eine sehr enge Beziehung zwischen dem Besitz des Merkmals und dem Auftreten der genannten Krankheit. Anders verhält es sich bei Patienten mit einem niedrigen relativen Risiko. Hier ist das Merkmal zwar häufig bei Kranken zu finden, der Besitz des Merkmals ist jedoch nicht eng mit dem Auftreten einer Erkrankung verbunden.
Fazit: Es gibt einige wenige nachweislich erbliche Krankheiten, die auf die Veränderung eines einzelnen Gens zurückzuführen sind (monogene Erkrankungen). Einige Erkrankungen sind an das Vorhandensein eines Y-Chromosoms gebunden. Für einen weitaus größeren Teil existiert eine gewisse Assoziation zu bestimmten Merkmalen, die auf Eiweißebene bestimmt werden können und ein „relatives Risiko“ erwarten lassen. Direkte Zusammenhänge zwischen Veränderungen im genetischen Bestand und psychischen Erkrankungen, Alkoholismus oder Homosexualität werden sehr kritisch diskutiert.
