Bluttransfusion. Bekanntermaßen setzen Bluttransfusionen voraus, daß der Spender die gleiche Blutgruppe besitzt wie der Empfänger. Dazu werden in der Regel nur die Allele des ABO-Blutgruppenmerkmals, also die Blutgruppe und der „Rhesusfaktor“ bestimmt und ein Kreuztest zwischen Empfängerserum und Erythrozyten des Spenders durchgeführt.
Tab. 18: Blutgruppenverträglichkeit (X = verträglich) unter Einbeziehung des Rhesusfaktors. Die Zeichen + und – bei der Angabe der Blutgruppe zeigen den Besitz des Rhesusfaktors an.
| Spender | ||||||||
|---|---|---|---|---|---|---|---|---|
| Empfänger | 0- | 0+ | A- | A+ | B- | B+ | AB- | AB+ |
| AB- | X | X | X | X | ||||
| AB+ | X | X | X | X | X | X | X | X |
| A+ | X | X | X | X | ||||
| A- | X | X | ||||||
| B+ | X | X | X | X | ||||
| B- | X | X | ||||||
| 0+ | X | X | ||||||
| 0- | X | |||||||
Die Übereinstimmung der Blutgruppe ist allerdings für eine geplante Bluttransfusion unverzichtbar, da jeder Mensch entsprechend seiner Blutgruppe seit seiner Geburt „natürliche“ Antikörper besitzt, die Erythrozyten einer anderen Blutgruppe verklumpen (agglutinieren) können: Personen mit der Blutgruppe A besitzen Antikörper gegen Erythrozyten der Blutgruppe B, Personen mit der Blutgruppe B solche gegen Blutgruppe A, Personen mit der Blutgruppe 0 solche gegen Blutgruppe A und B. Personen mit der Blutgruppe AB besitzen weder Antikörper gegen A noch gegen B. So ergibt sich – bei gleichzeitiger Berücksichtigung des Rhesus(Rh)-Merkmals – für eine blutgruppenkompatible Bluttransfusion das in Tab. 18 dargestellte Schema. Der Tabelle ist zu entnehmen, daß es sich bei Personen mit der Blutgruppe 0 um Universalspender, bei jenen mit der Blutgruppe AB um Universalempfänger handelt. Soweit die ziemlich überschaubaren Verhältnisse bei der Bluttransfusion.
Organtransplantation. Auch bei der Organtransplantation wird die Übereinstimmung der Blutgruppe von Spender und Empfänger und ein Erythrozytenkreuztest gefordert. Mindestens zwei weitere immunologische Voraussetzungen müssen jedoch erfüllt sein, daß einer klinischen Organtransplantation zugestimmt werden kann:
- Erstens darf der Organempfänger keine Antikörper gegen Gewebeantigene des vorgesehenen Organspender gebildet haben und zweitens muß ein Minimum an Übereinstimmung der Gewebeantigene zwischen Spender und Empfänger garantiert werden. Erstere Forderung wird durch den sog. Kreuztest (Crossmatch) zwischen Empfängerserum und Lymphozyten des Organspenders erfüllt.
- Die Erfüllung der zweiten Forderung gestaltet sich wegen des gewaltigen Polymorphismus der Gewebeantigene schon weitaus schwieriger.
| Spendertypisierung: | A1-A2 | B7-B27 | DR3-DR6 |
| Empfängertypisierung: | A2-A23 | B27-B44 | DR3-DR5 |
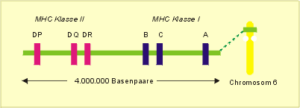
In der klinischen Praxis werden für Organspender und -empfänger die Gewebeantigene (HLA-Antigene) bestimmt, die durch die Gene der Loci A, B und DR des MHC kodiert werden (Abb. 45). Im vorliegenden Beispiel einer Gewebetypisierung (Tab. 19) stimmen die Muster in drei Allelen überein, in drei Allelen ergibt sich eine Nichtübereinstimmung (Mismatch). Für eine Transplantation wird nach den internationalen Regeln oft je eine Mindestübereinstimmung der Allele in den drei HLA-Loci A, B und DR des MHC gefordert. Unter bestimmten Bedingungen können Transplantationen jedoch auch bei Vorliegen höherer Mismatch-Grade (z. B. bei hoher Dringlichkeit) zugelassen werden – immer Blutgruppenübereinstimmung vorausgesetzt. Für die Auswahl geeigneter Spender-Empfänger-Paare werden bei der Knochenmarktransplantation Allele weiterer MHC-Loci in Betracht gezogen.
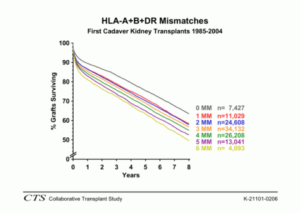
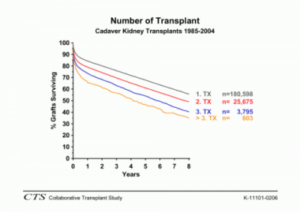
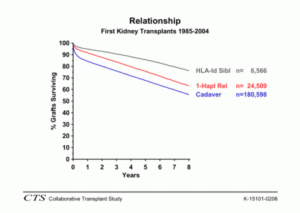
Sehr gute Ergebnisse werden bei Transplantationen zwischen Zwillingen mit identischem Allelmuster erreicht, wobei die seltenen Transplantationen zwischen eineiigen Zwillingen erwartungsgemäß zu den besten Resultaten führen. Auch die Transplantationen zwischen Blutsverwandten mit halbidenten (haploidenten) Mustern zeigen eindeutig bessere Ergebnisse im Vergleich zu allen anderen Transplantationen von nichtverwandten Leichennieren (Abb. 48). Als Ursache kann angenommen werden, daß enge Blutsverwandte per se viele nicht typisierte oder typisierbare Gewebemerkmale (Allele) gemeinsam haben. Bei Organen von Nichtverwandten, wie sie nach Entnahme von Organen Verstorbener eingesetzt werden, würde man dementsprechend eine hohe Dunkelziffer an immunologisch fremden Gewebemerkmalen vermuten.
TODO: Hier muss noch ein Bild rein (Warteliste)

Xenotransplantation. Von Jahr zu Jahr liegt die Anzahl bedürftiger Patienten auf der Warteliste und das Organangebot bzw. die Zahl durchgeführter Transplantationen weit auseinander (Abb. 49), so daß schon lange nach alternativen Wegen gesucht wird, diese Schwierigkeiten zu überwinden. Einer der Lösungswege liegt in der Schaffung von Möglichkeiten, Organe von Tieren für die klinische Transplantation zu verwenden (Xenotransplantation). Zur Zeit gehören bestimmte Schweinerassen zu den favorisierten Kandidaten. Ihre Organe haben etwa die gleiche Größe, Anatomie und Physiologie wie diejenigen des Menschen. Ihre kurzen Reproduktionszyklen mit einer großen Nachkommenschaft sowie die geringen Haltungskosten sind Argumente für ein solches Vorgehen. Eines der großen Hindernisse besteht jedoch darin, daß das Gewebematerial fremder Tierarten im Vergleich zu Gewebe fremder Individuen der gleichen Tierart wesentlich stärkere Immunreaktionen auslöst. So ist man bestrebt, durch Genmanipulation die vorgesehenen Spendertiere zu „humanisieren“. Dazu muß u.a. das Alpha-3-Transferase-Gen ausgeschaltet werden. Es kodiert ein Protein, das vom menschlichen Immunsystem als fremd erkannt wird. Darüberhinaus müssen noch drei weitere Gene in das Genom des Schweins eingebracht werden, um die Fremderkennung zu unterdrücken. Letzten Endes soll ein „konditioniertes“ Klonschwein entstehen, dessen Organe nach ihrer Verpflanzung vom Menschen toleriert werden.
Kritiker der Xenotransplantation befürchten allerdings, daß das Verpflanzen von tierischen Organen zu neuen Krankheiten beim Menschen führen könnte. So wie es beim Menschen – wie wir weiter unten sehen werden – z.B. schlummernde Retroviren wie das HI-Virus gibt, haben auch Schweine in ihren Chromosomen solche Informationen zur Bildung kompletter Viruspartikel, die den Menschen infizieren könnten. Mittlerweile sind Berichte über krebserregende Herpesviren und Viren, die eine tödliche Hirnhautverletzung beim Menschen erzeugen können, bekannt geworden. Diese Befürchtungen sind um so begründeter, wenn man bedenkt, daß das Immunsystem durch die zwingende immunosuppressive Behandlung nach Transplantation stark geschwächt ist.
Fazit: Bei Transfusionen und Organtransplantationen müssen für eine erfolgreiche Behandlung die allelen Unterschiede zwischen den Individuen berücksichtigt werden. Die Vielfalt der individuellen Allelmuster der Gewebeantigene macht es im Rahmen der klinischen Organtransplantation so schwierig, für prospektive Organempfänger Spender mit übereinstimmenden Allelmustern zu finden, so daß in den meisten Fällen eine unvollständige Übereinstimmung in Kauf genommen werden muß. Die Ergebnisse (Transplantatüberleben) hängen eindeutig von der Anzahl der übereinstimmenden Allele ab. Die besten Ergebnisse werden bei Transplantationen zwischen Verwandten, insbesondere zwischen Zwillingen, erzielt.
