Die Natur hat – dies trifft zumindest auf die Wirbeltiere zu – ein Erkennungssystem entwickelt, das nicht nur Artdifferenzen erkennt, sondern darüberhinaus auch molekulare Differenzen zwischen einzelnen Individuen der gleichen Art. Dabei handelt es sich um den höchsten Grad adaptiver (erworbener) molekularer Individualität, nämlich um die Anpassung des Individuums an die in jedem Moment existierenden aktuellen spezifischen Erfordernisse. Wir werden uns also in den folgenden Absätzen mit einigen interessanten Aspekten der Immunologie beschäftigen, soweit sie zum Thema molekulare Individualität beitragen.
Träger der Selbst- und Fremderkennung sind die Immunzellen. Dabei handelt es sich in erster Linie um eine Population von weißen Blutkörperchen (Leukozyten), die hauptsächlich im Blutkreislauf und im lymphatischen System zu finden sind und dort wiederum konzentriert in den Lymphknoten, der Milz und dem Thymus (vgl. Abschnitt „Homingmoleküle“). Wegen ihres bevorzugten Vorkommens im lymphatischen System haben sie den Namen Lymphozyten erhalten.
Das Prinzip der spezifischen Fremderkennung ist erst einmal leicht zu verstehen: Die für die Fremderkennung zuständigen Lymphozyten besitzen an ihrer Zelloberfläche – also in der Zellmembran – bestimmte Moleküle (Rezeptoren) mit einer Struktur, die mehr oder weniger genau komplementär zu der zu erkennenden Struktur (Immunogen, Antigen) ist (Schlüssel-Schloss-Prinzip). Bei den die Immunantwort auslösenden Immunogenen handelt es sich wie bereits beschrieben um lösliche Moleküle, Epitope auf Oberflächenmolekülen von Zellen (z.B. Bakterien) oder Zellverbänden. In der Regel werden die fremden immunogenen Strukturen nicht direkt an ihren komplexen Trägern (z.B. Bakterien) erkannt. Die großen Strukturen werden meist zuerst zerkleinert (antigen processing) und die entstehenden Bruchstücke von speziellen antigenpräsentierenden Zellen den erkennenden Immunzellen dargeboten.
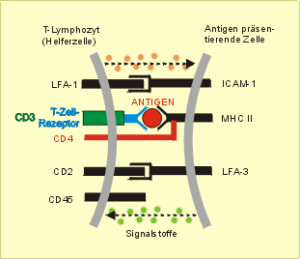
Zur Antigenerkennung (Abb. 41) sind neben der spezifischen Reaktion zwischen dem strukturspezifischen Erkennungsrezeptor und dem präsentierten Antigen zusätzliche Signale erforderlich, die durch die Reaktion weiterer komplementärer Strukturen auf der Immunzelle bzw. antigenpräsentierenden Zelle und diverse Signalstoffe ausgelöst werden. Das wichtigste zweite Signal ist die Erkennung vom „Selbst“ , in Abb. 41 durch die Verbindung zwischen CD4 und MHC II markiert (Doherty und Zinkernagel 1974, Nobelpreis 1996).
Die einzelnen Lymphozyten unterscheiden sich u.a. durch die Spezifität ihrer Erkennungsrezeptoren. Wird eine Struktur als fremd erkannt, so werden nur diejenigen Lymphozyten zur Vermehrung (Proliferation) angeregt, die diesen spezifischen Rezeptor besitzen. Diese so aktivierten Lymphozytenklone entwickeln sich über mehrere Stufen hauptsächlich in den Lymphknoten und der Milz zu den eigentlichen Effektoren mit hoher Spezifität und ihren letztendlich zerstörerischen oder neutralisierenden Wirkungen gegen das Fremde.
Wir unterscheiden humorale und zelluläre Immunität, je nachdem, ob es sich bei den Endprodukten (Effektoren) um Antikörper (also lösliche Moleküle) oder zytotoxische Immunzellen (z.B. Killerzellen) handelt. Die Erkennungszellen sind jedoch in jedem Fall Lymphozyten – genauer gesagt T-Lymphozyten, eine Subpopulation (Untergruppe) der Lymphozyten. Sichtbarer Hinweis auf die Richtigkeit dieser Aussage ist die Beobachtung, daß sich das Vollbild der Immunschwächekrankheit AIDS durch den fast völligen Zusammenbruch der spezifischen Immunantwort auszeichnet. Er ist bedingt durch die extrem starke Reduzierung der T-(Helfer)-Lymphozyten mit der Folge einer therapeutisch kaum zu beherrschende Vielfalt an Infektionen.
Dabei stoßen wir nochmals auf die Gretchenfrage der Immunologie: Wie kommt es, daß der Organismus gegen so viele verschiedene fremde Antigene spezifisch regieren kann, jedoch in der Regel die körpereigenen Strukturen ausspart?
Die lange als Lehrmeinung geltende Hypothese von Fenner und Burnet (1949), daß alle Lymphozytenklone mit einem Erkennungsrezeptor für körpereigene Moleküle während der Embryonalphase eliminiert werden und folglich nur Lymphozyten mit Spezifitäten gegen fremde Moleküle nach der Geburt zur Verfügung stehen, kann heute nicht mehr aufrechterhalten werden. Offensichtlich handelt es sich bei dieser Art spezifischer Immuntoleranz eher um einen aktiven Prozeß, der durch eine spezielle Population der T-Lymphozyten, die T-Suppressor-Lymphozyten, vermittelt wird. Aus vielen Tierversuchen wissen wir, daß diese spezifische Immuntoleranz auch künstlich erzeugt werden kann. Unter ausgeklügelten Versuchsbedingungen appliziert man den Tieren, die tolerant gegen ein bestimmtes Antigen gemacht werden sollen, dieses Antigen. Im Idealfall reagieren die Tiere nach dieser Behandlung nicht mehr oder stark abgeschwächt gegen das applizierte Antigen.
Dies ist auf den ersten Blick ein paradoxer Vorgang: Anstatt die Immunabwehr in Gang zu setzen, wird die Reaktion völlig oder zumindest partiell unterdrückt. Bei näherer Untersuchung stellt sich heraus, daß sich spezifische Suppressorzellen gebildet haben, die wiederum durch bestimmte Botenstoffe die „normale“ spezifische Immunreaktion herabsetzen. Es handelt sich also bei der Immuntoleranz eher um einen aktiven spezifischen Prozeß. Die Allergiker unter Ihnen kennen das Prinzip der Desensibilisierung: Dem Patienten werden – meist im Vorfeld einer zu erwartenden Allergenbelastung – in steigenden Dosen Präparate des Allergens (Pollenextrakte, Hausstaub u.a.) verabreicht in der Absicht, eine Nichtreaktivität gegen das oder die Allergene zu erreichen. Obwohl die Ursachen des erreichten Effektes noch nicht vollständig geklärt sind, scheinen solche Prozesse der Toleranzinduktion beteiligt zu sein.
Die Erfolge auf dem Gebiet der Organtransplantation würden heute wesentlich anders aussehen, wenn man in der Lage wäre, die Abstoßung der Transplantate auf diese Weise, nämlich durch spezifische immunologische Vorbehandlung der Transplantatempfänger mit Organmaterial des prospektiven (zukünftigen) Spenders, zu verhindern. Mit bestimmten Mäusestämmen ist tatsächlich auf diese Weise eine beeindruckende Immuntoleranz zu erreichen, so daß in vielen Fällen eine lebenslange Akzeptanz von Transplantaten genetisch differenter Inzucht-Mäusestämme erreicht wird. Beim Menschen kann man bisher nicht auf solche Erfolge zurückblicken. Allerdings gibt es Erfahrungen aus der klinischen Praxis, die zeigen, daß im Rahmen der Nierentransplantation (Leichenspender) die Gabe einer beschränkten Anzahl von unausgewählten Bluttransfusionen zu einer signifikanten Erhöhung der Transplantatüberlebenszeit führen kann. Hierbei handelt es sich neben ausgewählten klinischen Studien hauptsächlich um retrospektive Analysen, wobei die Transfusionen aus anderen Indikationen verabreicht wurden als mit dem Ziel der Induktion einer Immuntoleranz. Auslöser der Immuntoleranz sollen dabei paradoxerweise bestimmte Antigene der in den Blutpräparaten vorhandenen Lymphozyten sein.
Daneben gibt es weltweit umfangreiche Studien über den Einfluß spenderspezifischer Bluttransfusionen auf das spätere Transplantatschicksal im Fall von Lebendspendern – meist genetisch Verwandten. Hierbei wurde den vorgesehenen Transplantatempfängern Wochen vor der geplanten Transplantation Bluttransfusionen verabreicht mit dem Ziel der Toleranzinduktion. Ein nicht ganz unproblematisches Vorgehen: Es gibt nicht nur keine Garantie für den Erfolg, sondern es besteht darüberhinaus die Gefahr, daß der Organempfänger durch dieses Vorgehen sensibilisiert wird, d.h. spezifische Antikörper oder zytotoxische Lymphozyten gegen das Spenderorgan gebildet werden, die nach der Einpflanzung des Organs zu seiner Schädigung oder Abstoßung führen können.
Nun war bisher viel von spezifischen Killerzellen und spezifischen Antikörpern als Endprodukte der Immunantwort die Rede. Wir haben erfahren, welch weite Wege die Immunzellen im Körper zurücklegen müssen, um von Station zu Station zu wandern bis funktionsfähige Immuneffektoren entstehen konnten, die dann wiederum noch an den Ort der Immunattacke geschafft werden mußten (Homing). Dieser zeitliche Aufwand ist der Preis für die hohe Spezifität. Für Feuerwehreinsätze steht uns ein zweites System der Fremderkennung und -abwehr zur Verfügung, das bereits in der frühen Entwicklungsgeschichte der Organismen existierte, als es das adaptive spezifische Abwehrsystem noch nicht gab. Auch hier finden wir molekulare humorale und zelluläre Komponenten, die in einem sehr komplexen Zusammenspiel prompt und effektiv die erste Barriere gegen Fremdes darstellt. Wir kennen die Auswirkungen dieser Reaktionen aus unserer täglichen Erfahrung, wenn wir uns verletzen und Entzündungen entstehen.
Gibt es auch ein Immunsystem bei Pflanzen? Pflanzen und Wirbellose besitzen offensichtlich kein adaptives spezifisches Abwehrsystem wie die Wirbeltiere. So liegt die Frage nahe, auf welche Art und Weise diese Lebewesen Fremdes erkennen und entsprechend reagieren. Wie zuletzt beschrieben wurde, besitzen auch wir Menschen neben dem spezifischen erworbenen Immunsystem ein zweites, schnell aber unspezifisch reagierendes Immunsystem, das eng mit dem erworbenen spezifischen Immunsystem kooperiert. Heute weiß man, daß es sich beim angeborenen Immunsystem um ein biologisches Prinzip handelt, das über viele Jahrmillionen genetisch konserviert wurde, also auch bei Wirbellosen und Pflanzen vorkommt.
Offensichtlich existiert bei Letzteren ein Repertoire feststehender Strukturen (Rezeptoren), die in der Lage sind, Fremdes zu erkennen und daraufhin Signalstoffe zu erzeugen, die die Aktivierung bestimmter Abwehrgene bewirkt. Im Vergleich zu Tieren scheinen Pflanzen über eine wesentlich höhere Anzahl solcher Rezeptoren zu verfügen, die durch hunderte von Resistenz-Genen kodiert werden, um den Befall mit Bakterien, Pilzen, Viren und Würmern zu erkennen und deren Ausbreitung abzuwehren. Analoge Signalstoffe existieren, soweit untersucht, bei allen Tier und Pflanzenarten. Zusätzlich zu den räumlich begrenzten Reaktionen antworten viele Pflanzen auf eine Infektion mit der Aktivierung der Abwehr auch in den nichtinfizierten Pflanzenteilen. Die Folge ist eine breite (systemische) Resistenz gegen ein großes Spektrum mikrobieller Produkte in der gesamten Pflanze. Diese Art zu reagieren ist vergleichbar mit der durch die angeborene Immunität vermittelten adaptiven Immunität bei den Wirbeltieren.
Fazit: Die Wirbeltiere besitzen einen Mechanismus zur Erkennung und Unterscheidung von Selbst und Fremd. Immunzellen können nicht nur Moleküle fremder Tierarten erkennen, sondern auch solche anderer Individuen der gleichen Tierart. Zur Präsentation und Erkennung des aufgearbeiteten Antigenmaterials sind mehrere Signale in Form von Reaktionen zwischen komplementären Zelloberflächenmolekülen der beteiligten präsentierenden und erkennenden Zellen und der Austausch molekularer Signalstoffe erforderlich. Dabei müssen die kooperierenden Zellen als eigen und das zu eliminierenden Material als fremd erkannt werden. Der Erkennung folgt eine Vermehrung der jeweils antigenspezifischen Immunzellen. Man unterscheidet humorale und zelluläre Immunität. Die humorale Immunität wird über antigenspezifische Antikörpermoleküle (Immunglobuline) vermittelt, die zelluläre Immunität über antigenspezifische Immunzellen.
